
Strategie per limitare i solfiti nei vini – Quali alternative? Parte 1/3: Comparto microbiologico, bioprotezione e stadi pre-fermentativi
Publiée le 11/04/2018 14:51Questo è il primo di tre articoli riguardanti l’impiego dei solfiti nel vino e le strategie per ridurli. E’ stato
tratto dalla rivista “Revue des OEnologues” n. 160/2016. La selezione e la relativa traduzione è stata curata
dall’enologo Paolo Peira.
Strategie per limitare i solfiti nei vini – Quali alternative?
Parte 1/3: Comparto microbiologico, bioprotezione e stadi pre-fermentativi
Olivier Pillet1, François Davaux2, Philippe Gabillot3, Stéphanie Peyrot4, Anthony Silvano5, Bertrand Robillard1
1 Institut œnologique de Champagne – Epernay – France.
2 Institut français de la Vigne et du Vin – Lisle-Sur-Tarn – France.
3 Chambre d’agriculture Indre-et-Loire – Chambray-les-Tours – France.
4 Euralis – Izon – France.
5 Lallemand SAS – Blagnac – France.
Introduzione
Il diossido di zolfo (SO2) è un ausiliario tecnologico essenziale in enologia poiché molti sono i suoi benefici, sia sotto il profilo del controllo microbiologico, sia nella prevenzione dei fenomeni di ossidazione.
Tuttavia, il SO2 è messo sotto l’indice in ragione dei suoi numerosi inconvenienti:
- Tossico per l’organismo umano, presenta un pericolo per il consumatore e per l’elaboratore in cantina;
- Possibile precursore di aromi solforati, detti “di riduzione”, prodotti durante la fermentazione alcolica (Henschke e Jiranek, 1991);
- Possibile ossidazione a solfati, spesso considerati come responsabili della sensazione di “secchezza” in degustazione;
- L’anidride solforosa può provocare, attraverso il lievito, la formazione di acetaldeide, altra molecola potenzialmente indesiderabile (Cleroux et al., 2015);
- Il suo odore è percettibile e può mascherare alcuni aromi positivi del vino (Peynaud e Blouin, 1991);
- Combinandosi con gli antociani, pigmenti dei vini rossi e rosati, provoca una parziale decolorazione, reversibile.
Per queste ragioni, numerose ricerche hanno come obiettivo di ridurre il suo utilizzo in enologia e di trovare delle valide alternative.
In questa prima parte, vengono valutati alcuni strumenti biotecnologici alternativi, provenienti da un approccio essenzialmente microbiologico, per gestire le fasi pre-fermentative.
Infatti, durante il periodo che va dalla raccolta dell’uva all’avvio della fermentazione alcolica (FA), una flora indigena può svilupparsi nei mosti, producendo metaboliti indesiderati nei confronti della qualità finale del vino e della sua definizione sensoriale: produzione di acido acetico, di amine biogene, di fenoli volatili, o ancora difficoltà di impianto del lievito enologico inoculato in una seconda fase, per realizzare la FA.
L’anidride solforosa, sotto la sua forma molecolare H2SO3, rappresenta quindi uno strumento incontestabile per gestire questi rischi (Deveze, 1977). Si considera che un livello di SO2 molecolare corrispondente a 0,5 mg/l sia battericida, mentre questo non è sufficiente per avere un effetto fungicida. Usseglio-Tomasset (1995) ha dimostrato che per ritardare la fermentazione alcolica di 50 ore, 0,5 mg/l di SO2 attiva sono necessari per far fronte a Saccharomyces cerevisiae mentre ne servono 3,5 mg/l per far fronte a Saccharomyces uvarum. Il pH gioca un ruolo determinante poiché più questo è elevato più la proporzione di SO2 molecolare è bassa. Le basse temperature così come l’assenza di etanolo, condizioni riscontrate in fase pre-fermentativa, diminuiscono ugualmente l’attività della SO2 molecolare.
Per questo motivo, la messa in opera di strategie di lotta microbiologica, per mezzo di microrganismi selezionati, potrebbe rappresentare un’alternativa di sicuro interesse per ridurre l’uso della solfitazione.
Inoculo frazionato di S. cerevisae durante la macerazione pre-fermentativa di uve nere.
Una prima strategia per limitare questi rischi consiste nell’inoculare prima possibile il lievito scelto per realizzare la fermentazione alcolica. Tuttavia, nella situazione – frequente – di macerazione pre-fermentativa ad una temperatura superiore ai 10°C, con questa tecnica è possibile assistere ad avvii di fermentazione troppo precoci, specie se l’inoculo viene fatto a piena dose (20-25 g/hl), a detrimento del lavoro di estrazione in fase acquosa, ricercato dal vinificatore in questo tipo di processo. Per questo motivo, un’alternativa raccomandata all’inoculo precoce è che questo venga frazionato in due tempi; in una prima fase l’inoculo viene eseguito con basse dosi di lievito, prima della macerazione pre-fermentativa, per evitare avvii indesiderati della FA, in seguito si aggiunge una dose di lievito più importante quando l’estrazione in fase acquosa è considerata conclusa.
In questo studio vengono confrontati questi due protocolli (inoculo precoce ed inoculo frazionato) su del Pinot nero macerato per 4 giorni a 14°C con un inoculo a piena dose differito, cioè effettuato al termine della macerazione. In seguito vengono misurate le popolazioni microbiche presenti. I risultati (figura 1) mostrano che più l’inoculo è precoce, migliore è la repressione della popolazione non-Saccharomyces indigena. Il protocollo detto frazionato rappresenta un livello di repressione intermedio, di cui non si può essere completamente soddisfatti. In definitiva, sarebbe quindi preferibile controllare la microflora indigena il prima possibile, apportando un lievito selezionato a forte dose ma senza che questo provochi l’innesco della FA o, in alternativa, assicurarsi di effettuare una macerazione pre-fermentativa ad una temperatura più bassa, così da ostacolare l’avvio della FA.
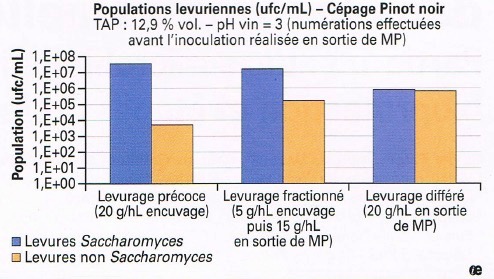
Figura 1: Popolazioni lievitiformi numerate su mezzo gelosato al termine della macerazione pre-fermentativa (MP) di uve nere in funzione del momento di inoculo dei lieviti.
Impiego di Torulaspora delbueckii nelle operazioni pre-fermentative di mosti bianchi.
Un secondo tentativo ha riguardato un approccio di bioprotezione dei mosti bianchi per mezzo di un lievito non-Saccharomyces proveniente dalla specie Torulaspora delbueckii, naturalmente presente nel mosto, anche se non maggioritaria. Il lievito considerato per l’esperimento, BiodivaTM, presenta effettivamente alcune caratteristiche interessanti: debole produzione di acidità volatile ed altri metaboliti indesiderabili, criotolleranza ma non criofilia. Quest’ultimo aspetto è essenziale per il percorso che si intende intraprendere. Questo ceppo di T. delbueckii, può quindi impiantarsi senza subire grosse perdite in mosti a bassa temperatura (a partire da 5°C) ma necessita di temperature elevate (superiori a 15°C) per avviare la FA. In questo modo si può assicurare un controllo microbiologico precoce (già inoculando all’uscita della pressa) senza innescare la fermentazione alcolica in presenza dei fondi di decantazione.
La sperimentazione è stata così realizzata su mosto di Sauvignon nella cantina sperimentale dell’IFV Sud-Ouest, a Lisle-sur-Tarn, confrontando le tre modalità seguenti:
- Il testimone viene solfitato con 5 g/hl al riempimento del serbatoio di decantazione;
- Lo stesso mosto, non solfitato, viene addizionato di un preparato antiossidante a base di lieviti inattivi;
- Lo stesso mosto, non solfitato, viene addizionato di un preparato antiossidante a base di lieviti inattivi ed inoculato con BiodivaTM (7 g/hl – 3,5.106 cellule/ml).
Le tre modalità sono state lasciate in decantazione a 5°C per 15 giorni, con enzima (Inozyme Clear, 4 g/hl). Sono state quindi numerate le popolazioni di lievito sui fondi di decantazione, dopo spillatura del pulito (figura 2). La solfitazione mostra chiaramente la sua efficacia per limitare lo sviluppo dei lieviti potenzialmente contaminanti, Saccharomyces o non-Saccharomyces. Inoculo con biodivaTM ha ugualmente mostrato una forte propensione a controllare lo sviluppo di lieviti del genere Saccharomyces, equivalente a quella della solfitazione mentre la flora non-Saccharomyces ritrovata corrisponde alla popolazione di T. delbueckii che era stata inoculata. Questo lievito rappresenta quindi uno strumento certo per la bioprotezione pre-fermentativa dei mosti, necessita tuttavia di un controllo della temperatura del mosto (inferiore a 12°C) al fine di evitare l’avvio di FA precoci.
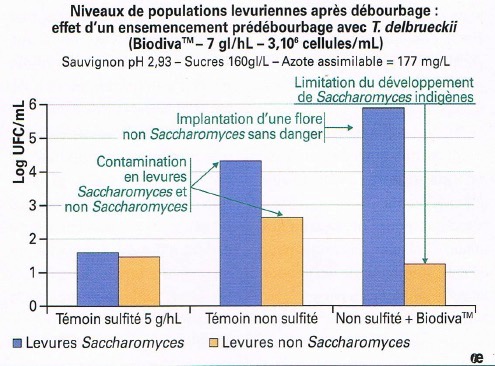
Figura 2: Biocontrollo delle popolazioni lievitiformi su mosto bianco trattato con Torulaspora delbrueckii. Conta su mezzo YPD con cloroamfenicolo. Lieviti totali: 25°C per 5 giorni. Lieviti Saccharomyces: 35°C per 2 giorni.
Impiego di Metschnikowia fructicola nelle operazioni pre-fermentative di mosti rossi.
Macerazione pre-fermentativa a freddo
In alcune situazioni di macerazioni pre-fermentative dette “a freddo”, le temperature sono talvolta mal gestite e si avvicinano più ai 12-16°C rispetto che agli 8°C previsti. Per questa ragione, IFV Beaune ha selezionato un lievito Metschnikowia fructicola senza potere fermentativo, GaïaTM, al fine di offrire un biocontrollo massiccio, con un forte dosaggio (20 g/hl, popolazione dell’ordine di 9.106 cell/ml), limitando però il rischio di avvio precoce di FA.
La specie di lievito M. fructicola, isolata recentemente sull’uva (Kurzman e Droby, 2001) era già nota per l’inibizione che questa esercita nei fruttai nei confronti delle muffe (Liu et al., 2011) e su Botrytis. L’utilizzo di GaïaTM in enologia nel caso di macerazione pre-fermentativa delle uve nere era già stata descritta da Gerbaux et al. (2015) e vale quindi la pena di ricordare alcune sue qualità:
- Eccellente potere di impianto e di moltiplicazione, senza potere fermentativo;
- Repressione dello sviluppo dei lieviti Kloeckera apiculata, responsabili frequenti degli aumenti di acidità volatile durante la macerazione pre-fermentativa – Kloeckera può anche produrre circa dieci volte più di acetato di etile che Saccharomyces (Blondin, 2011);
- Limitazione dell’acidità volatile in situazioni di contaminazione di Kloeckera (tabella 1);
- Assenza di metaboliti indesiderati e migliore attitudine sensoriale rispetto ad altri lieviti Metschnikowia testati nel programma di selezione.
L’esperimento è stato condotto su piccoli lotti di 3 kg di Syrah presso Vaucluse. Si sono confrontate le seguenti modalità:
- Il testimone viene solfitato con 6 g/hl sulle uve, prima della diraspa-pigiatura;
- Il mosto subisce una doppia solfitazione, oltre quella iniziale, un’aggiunta supplementare di 6 g/hl di SO2 dopo un giorno di macerazione a 10°C;
- Modalità GaïaTM: nessuna solfitazione, inoculo con GaïaTM (20 g/hl sulle uve prima della diraspa-pigiatura).
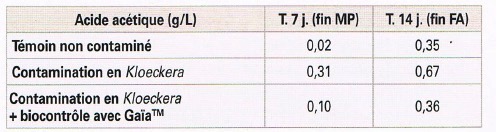
Tabella 1: Attività di Kloeckera apiculata nel mosto di Pinot nero con e senza biocontrollo con GaïaTM (secondo Gerbaux et al., 2015). Mosto pastorizzato: succheri 230 g/l, pH 3,20, no SO2 – macerazione pre-fermentativa per 7 giorni a 15°C, poi inoculo con Saccharomyces cerevisiae – FA a 20°-24°C.
Dopo la macerazione pre-fermentativa a 10°C per 48 ore sono state eseguite le conte dei lieviti totali e non-Saccharomyces, grazie all’ausilio del laboratorio del servizio tecnico d’Inter-Rhône, in seguito i lotti sono stati inoculati con il lievito Saccharomyces cerevisiae IOC 18-2007 (20 g/hl).
La popolazione riscontrata corrisponde essenzialmente a dei lieviti non-Saccharomyces (tabella 2).
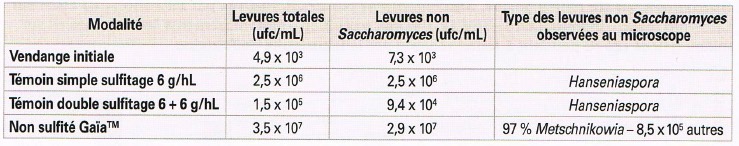
Tabella 2: Conta delle popolazioni lievitiformi effettuata dopo macerazione pre-fermentativa (10°C per 48 ore) – Syrah – Vaucluse – Zuccheri = 203 g/l
La doppia solfitazione consente una caduta importante di questa popolazione potenzialmente contaminante. Si osserva una popolazione importante di lieviti non-Saccharomyces nella modalità GaïaTM, il che è coerente con un eccellente impianto e moltiplicazione del lievito Metschnikowia fructicola inoculato, poiché è essenzialmente questo genere di lievito che è stato identificato attraverso l’osservazione morfologica al microscopio. Sui due testimoni solfitati, al contrario, si nota una presenza importante di lieviti identificati con il genere Hanseniaspora, noto per produrre potenzialmente acido acetico ed acetaldeide (Lonvaud-Funel et al., 2010). In questo caso, la repressione operata da Metschnikowia fructicola sembra essere migliore o almeno equivalente alla solfitazione iniziale con 6 g/hl.
Biocontrollo delle uve al momento della raccolta
Si è inoltre testato un utilizzo più precoce realizzando due sperimentazioni in campo, utilizzando GaïaTM sulle uve e sul mosto fresco nei rimorchi della vendemmia. L’aggiunta del lievito alla dose di 20 g/q di vendemmia, preferibilmente reidratato in acqua a 20°-30°C è stato effettuato durante il riempimento dei rimorchi. Questa pratica è stata confrontata con dei testimoni solfitati e non. Per assicurare l’omogeneità delle uve, tanto analitica quanto microbiologica, la vendemmia è stata effettuata a filari alterni. In tutte le modalità è stato inoculato un lievito S. cerevisiae (IOC R 9008), alla dose di 20 g/hl, dopo una macerazione pre-fermentativa di una notte, al fine di innescare la FA.
La prima prova, realizzata sul Merlot in Gironda, coadiuvata dal gruppo Euralis ha consentito di confrontare il percorso tradizionale con solfitazione ad una modalità senza solfitazione ma con aggiunta di GaïaTM. Su questa seconda modalità, è stata impiegata una leggera solfitazione (2 g/hl) a 2/3 della FA. Il controllo delle popolazioni lievitiformi (figura 3A) ha consentito di osservare una forte attività di biocontrollo operata da Metschnikowia fructicola. Si sottolinei che al riempimento del vinificatore si è osservata una forte popolazione non-Saccharomyces, testimonianza del buon impianto di GaïaTM, mentre al termine della macerazione, i lieviti S cerevisiae contaminanti sembrano essere repressi da GaïaTM. Questo determina che ai 2/3 della FA si osserva un migliore sviluppo del lievito S cerevisiae selezionato in questa modalità.
La seconda prova, realizzata sul Cabernet franc, coadiuvata dalla Chambre d’Agriculture d’Indre-et-Loire ha consentito di confrontare quattro modalità: un testimone solfitato in maniera classica, un testimone non solfitato, una modalità senza solfitazione ma con aggiunta di GaïaTM nei rimorchi di vendemmia ed infine una modalità identica alla precedente, fino a questo stadio, ma differente in seguito attraverso l’aggiunta di batteri enologici all’avvio della FA.
Come già visto in precedenza (figura 3B), si osserva, al riempimento del vinificatore, un buon impianto dei lieviti non-Saccharomyces, ascrivibile a Metschnikowia fructicola mentre il testimone non solfitato mostra una contaminazione potenzialmente negativa, rappresentata da una popolazione non-Saccharomyces che si è oltremodo sviluppata rispetto al testimone con solfiti. Ai 2/3 della FA, è interessante constatare nelle due prove con GaïaTM che questa permette un rapporto nello sviluppo S. cerevisiae/non-Saccharomyces favorevole al primo, in particolare il ceppo scelto ed inoculato dal vinificatore (figura 4). Questa osservazione tende a dimostrare che esercitando una repressione sulla flora indigena contaminante, Metschnikowia fructicola consente indirettamente un migliore sviluppo del lievito selezionato per la fermentazione, mettendo in sicurezza così questo stadio della vinificazione.
Conclusioni
Rispetto al potere antifungino della solfitazione nello stadio pre-fermentativo, alcuni lieviti non-Saccharomyces rappresentano un’interessante alternativa per controllare la flora microbiologica che popola il mosto e le uve, già a partire dalla raccolta. A questo proposito, il lievito GaïaTM, una Metschnikowia fructicola, impiegato in macerazione pre-fermentativa o in vigna sulle uve, ha dimostrato in diverse occasioni la sua efficacia volta a controllare una parte della microflora potenzialmente contaminante delle uve, così da poter rimpiazzare parzialmente o totalmente l’anidride solforosa.

Figura 3: Biocontrollo con M. fructicola delle popolazioni lievitiformi in situazione pre-fermentativa. A: test effettuato su Merlot – Gironda – TAV 14,3%vol. – pH 3,50 – Conta non-Saccharomyces su mezzo gelosato, Saccharomyces mediante qPCR, realizzato da Microflora. B: test effettuato su Cabernet franc – Indre-et-Loire – TAV 12,1%vol. – pH 3,25 – Conta lieviti totali su mezzo gelosato (25°C per 5 giorni), realizzato dal laboratorio di Touraine.
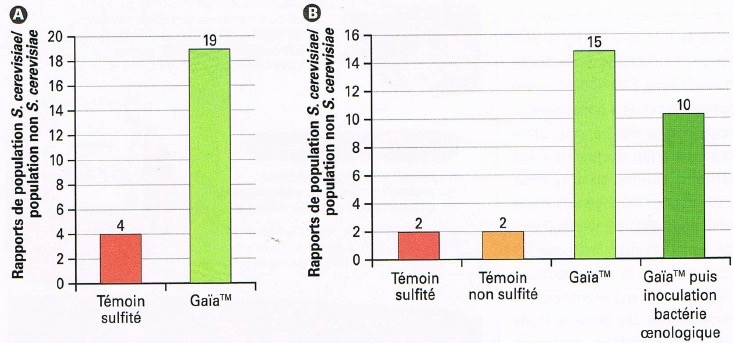
Figura 4: Rapporto delle popolazioni di lievito Saccharomyces/non-Saccharomyces, conta ai 2/3 della FA, su entrambe le prove. A: test effettuato su Merlot – Gironda – TAV 14,3%vol. – pH 3,50 – Conta non-Saccharomyces su mezzo gelosato, Saccharomyces mediante qPCR, realizzato da Microflora. B: test effettuato su Cabernet franc – Indre-et-Loire – TAV 12,1%vol. – pH 3,25 – Conta lieviti totali su mezzo gelosato (25°C per 5 giorni), realizzato dal laboratorio di Touraine.


